哪些特質最被審評機構看中,從而獲得更快的上市速度?
筆者回顧2018年第一季度進口新藥和仿制藥的獲批情況,以便了解目前CDE審評的趨勢。此外,對2018年第一季度的技術轉移情況也進行了統計。
從2018年第一季度獲批產品對應的優先審評速度來看,優先審評有助于加快速度,但過程中沒有被暫停和發補,才算可能得到最快的獲批速度。2018年4月28日國家藥品監督管理局有條件批準用于預防宮頸癌的九價人乳頭狀瘤病毒疫苗上市,其審批速度之快,在中國藥品審批歷史上史無前例,此案例是否屬于特例,仍待時間證明。進口新藥
4個產品1年內獲批上市
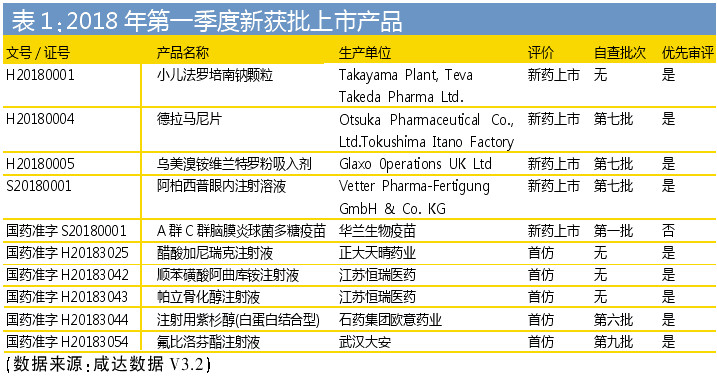
2018年第一季度,共有5個新藥產品獲批上市。其中,進口新藥有4個,分別為小兒抗感染藥法羅培南鈉顆粒、抗結核新藥德拉馬尼片、治療慢性阻塞性肺病的烏美溴銨維蘭特羅粉吸入劑和治療糖尿病性黃斑水腫的阿柏西普眼內注射溶液,都是在1年內獲批上市。
小兒抗感染藥法羅培南鈉顆粒早在2017年3月就進入優先審評,入選理由為“兒童用藥”,此產品沒有經過臨床自查核查但耗費將近一年審批時間,很大程度上是由于2017年4月7日其因“檢驗報告”暫停了審評,同年11月14日才恢復排隊。
大冢制藥的抗結核新藥德拉馬尼片2017年2月以“與現有治療手段相比具有明顯治療優勢”為由納入優先審評品種名單,同年5月19日進入第七批臨床自查核查名單(2017年第59號),并在6月23日進入藥物臨床試驗數據現場核查計劃公告(第12號)。其在排隊序列的延遲主要有兩個暫停,主要理由都是因為“檢驗報告”。
治療慢性阻塞性肺病新藥的葛蘭素史克烏美溴銨維蘭特羅粉吸入劑2017年4月申報進口上市,同年5月進入第七批臨床自查核查名單(2017年第59號),也是以“與現有治療手段相比具有明顯治療優勢”在9月被列入“擬納入優先審評程序藥品注冊申請的公示(第二十一批)”,緊接著進入了藥物臨床試驗數據現場核查計劃公告(第14號),9月排隊暫停理由是“等待臨床核查報告”,2018年1月排隊恢復。
此外,葛蘭素史克2016申報進口上市的糠酸氟替卡松維蘭特羅吸入粉霧劑(Ⅱ)和(Ⅲ)也在2018年1月進入了藥物臨床試驗數據現場核查計劃公告(第17號),其適應癥為治療哮喘。按目前的注冊審評速度,預計2018年下半年有望上市。
治療糖尿病性黃斑水腫(DME)的拜耳阿柏西普眼內注射溶液在2018年上市,暫不知道會否對治療新生血管性(濕性)年齡相關性黃斑變性(nAMD)的康柏西普眼用注射液和雷珠單抗注射液的現有市場造成沖擊。康柏西普和雷珠單抗2017年通過醫保談判進入醫保支付范圍。阿柏西普眼內注射溶液2017年3月受理號JXSS1700001申報注冊上市,5月受理號JXSS1700001進入第七批臨床自查核查名單(2017年第59號)和納入優先審評名單,6月受理號JXSS1700004進入第八批臨床自查核查名單(2017年第91號)并且也納入優先審評名單,兩個受理號分別進入藥物臨床試驗數據現場核查計劃公告(第12號)和藥物臨床試驗數據現場核查計劃公告(第14號),目前已獲批的是受理號JXSS1700001。阿柏西普申報暫停的時間主要耗在“質標說明書包裝標簽工藝”。
獲批的國內新藥為華蘭生物疫苗有限公司的A群C群腦膜炎球菌多糖疫苗,是第一批自查核查產品。其沒有獲得優先審評,歷經2015年12月和2016年10月兩次發補,2017年5月23日“三合一”審評完成后,于2018年2月才進入審批階段。
首仿獲批
都有優先審評資質
正大天晴2015年申報的醋酸加尼瑞克注射液終于獲得首仿上市。2016年10月該品曾獲得優先審評,同年11月發補;2017年4月才進入補充資料任務公示,5月底補充資料審評完成,12月才進入審批階段。
石藥集團歐意以化藥新分類直接報產注射用紫杉醇(白蛋白結合型),并以“臨床急需、市場短缺、首仿”為由獲得優先審評。Abraxis BioScience公司已在我國上市100mg注射用紫杉醇(白蛋白結合型)。2005年1月,由Abraxis BioScience公司開發的注射用紫杉醇(白蛋白結合型)被美國FDA批準上市。2010年新基以29億美元首付款收購Abraxis公司。新基去年7月在與百濟神州的交易中,將注射用紫杉醇(白蛋白結合型)在中國的市場權益授予了百濟神州。百濟神州將全面接管新基在中國的商業團隊,負責注射用紫杉醇(白蛋白結合型)在中國的商業推廣和銷售。值得注意的是,恒瑞也以首仿的理由獲得優先審評,預計短期內也會獲批。
武漢大安的氟比洛芬酯注射液也進入了優先審評,理由是“申請人主動撤回并改為按與原研藥質量和療效一致的標準完善后重新申報的仿制藥注冊申請”。武漢大安的氟比洛芬酯注射液曾是第一批自查核查的產品,2015年第255號公告撤回以后,以化學藥注冊分類新3類重新申報,從2017年6月30日進入CDE審評中心,同年9月4日獲得優先審評,9月13日進入第九批臨床自查核查名單(2017年第109號),10月10日被列入藥物臨床試驗數據現場核查計劃公告(第15號),11月29日通知生產廠家資料發補,2018年1月5日補交資料,3月12日獲批上市。氟比洛芬酯注射液2017年醫院樣本市場已超過11億元,首仿產品上市將爭奪現有產品的市場份額。
恒瑞2013年申報的帕立骨化醇注射液和2014年申報的順苯磺酸阿曲庫銨注射液,分別以“待審評的首仿品種名單”和“同一生產線生產,已在美國上市,申請國內上市的仿制藥”為由獲得優先審評,并在2018年上市成功。兩個產品在獲得優先審評之前,申報耗時最多的是排隊。由此可反映出首仿藥獲得優先審評的重要性。
技術轉移
落地仍在進行
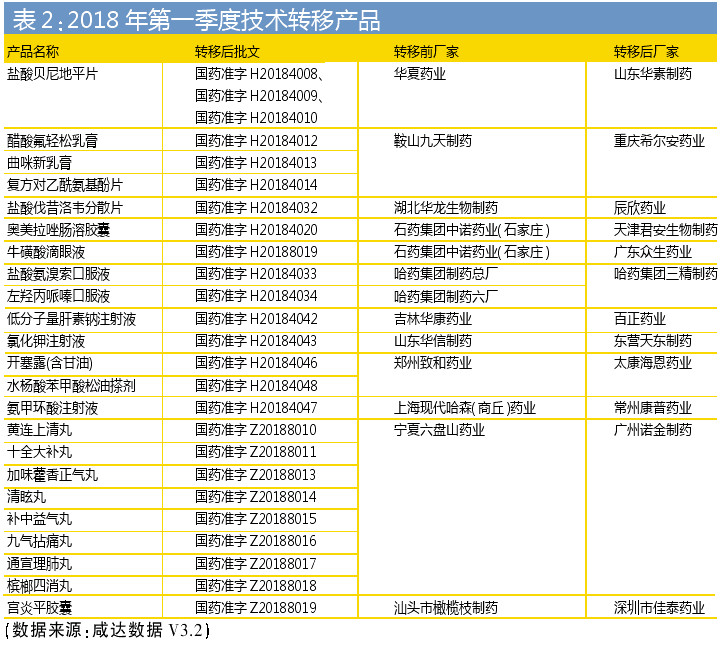
2018年第一季度,一些產品的技術轉移終于落地。以鹽酸貝尼地平為例。2013年1月,北京中關村四環醫藥開發有限責任公司之控股子公司北京華素制藥股份有限公司(簡稱“華素制藥”)與華夏藥業集團有限公司(簡稱“華夏藥業”)共同投資設立山東華素醫藥科技有限公司(簡稱“山東華素”,其中華素制藥持有其80%股份,華夏藥業持有其20%股份),山東華素以1億元對價向華夏藥業購買其所屬的鹽酸貝尼地平、鹽酸貝尼地平片(商品名“元治”)、格列吡嗪分散片(商品名“元坦”)藥品及包裝涉及的相關藥品生產技術、專利、注冊商標。時隔五年,產品的技術轉移才完成。
集團內的生產線整合,如哈藥集團制藥總廠和哈藥集團制藥六廠的口服液產品轉移到哈藥集團三精制藥有限公司,這意味著哈藥集團的口服液生產線有可能整合到哈藥集團三精制藥有限公司。
生化藥的轉移在2018年一季度也有案例,如吉林華康藥業股份有限公司的低分子量肝素鈉注射液,轉移到百正藥業股份有限公司。(來源:醫藥經濟報)